4. Akt
Mit tatkräftiger Unterstützung gelang es dem Alchemistenlehrling, einen neuen Weihnachtsbaum aufzutreiben. Aber wer hilft einem, so kurz vor Weihnachten Ersatz für die verbrannten Plätzchen zu bekommen? Das erfahrt ihr am 19. Dezember 2021, ab 12.00 Uhr.
Haben Sie folgende Anspielungen entdeckt?
Der vierte Akt unserer Weihnachtsvorlesung basiert auf der Ballade „Die Heinzelmännchen zu Köln“ von August Köpisch. In der Ballade können alle Einwohner faul sein, da nachts die Heinzelmännchen kommen und die Arbeit erledigen. Die Frau des Schneiders wird jedoch neugierig und stellt den Heinzelmännchen eine Falle. Daraufhin verschwinden alle von ihnen und fortan müssen die Bewohner wieder selbst fleißig sein.
Für (ehemalige) Mitglieder der Fakultät für Chemie und Physik: Wer genau hinsieht, erkennt vielleicht die „Heinzelmeschen“ der Fakultät wieder.
Experiment 1: Farbige Flammen
Was sehe ich?
Sie sehen Spiritusbrenner, deren Flammen farbig brennen.
Warum sehe ich das?
In den Spiritusbrennern befindet sich Methanol, in welchem Natriumchlorid (gelbe Flamme), Lithiumnitrat (rote Flamme), Borsäure (grüne Flamme) oder Indiumchlorid (indigoblaue Flamme) gelöst wurde. Durch die hohe Temperatur während der Reaktion des Methanols mit dem Sauerstoff der Luft (also der eigentlichen Verbrennung) werden die Außenelektronen der Metallkationen thermisch angeregt und geben beim Übergang in den Ausgangszustand die zuvor aufgenommene Energie in Form eines, für das jeweilige Element charakteristisch gefärbten, Lichts wieder ab. Die grüne Flamme des Borsäure-Methanol-Gemisches resultiert aus der Bildung des Borsäuretrimethylesters, welcher mit einer grünen Flamme verbrennt.
\begin{align} 2 CH_3OH + 3 O_2 &\rightarrow 2 CO_2 + 4 H_2O + \Delta T (mit~ \Delta T = Wärme)\\ NaCl + \Delta T &\rightarrow Na\cdot + Cl\cdot\\ InCl_3 + \Delta T &\rightarrow In\cdot + 3 Cl\cdot\\ 2 LiNO_3 + \Delta T &\rightarrow 2 Li\cdot + 2 NO_2 + O_2\\ M\cdot + \Delta T &\rightarrow M\cdot ^* \rightarrow M\cdot + h\cdot \nu \\ (mit~M = Metall, & ^* = angeregter~Zustand~und~h\cdot \nu = Licht)\\ B(OH)_3 + CH_3OH &\rightarrow B(OCH_3)_3 + 3 H_2O\\ 2 B(OCH_3)_3 + 9 O_2 &\rightarrow B_2O_3 + 6 CO_2 + 9 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Durch die photometrische Analyse des emittierten Lichts einer Sphalerit-Probe (Zinksulfid) aus dem Freiberger Revier konnten Ferdinand Reich und Hieronymus Theodor Richter 1863 an der Bergakademie Freiberg das Indium aufgrund seiner intensiven Indigoblauen Spektrallinie als neues Element identifizieren.
Die Reaktion von Borsäure mit Alkoholen wurde früher als Nachweis für Methanol genutzt, da der sich ergebende Borsäuretrimethylester eine komplett grüne Flamme bei der Verbrennung zeigt. Die Borsäureester von Alkoholen mit einem größeren Kohlenstoffanteil (zum Beispiel der Trinkalkohol Ethanol) zeigen bei der Verbrennung eine gelbliche Flamme mit grünem Saum, da der Kohlenstoff nicht vollständig zu Kohlenstoffdioxid oxidiert wird und die Rußpartikel in der Flamme gelb glühen. So kann Methanol in gepanschtem Trinkalkohol nachgewiesen werden.
Experiment 2: Sonnenuntergangsreaktion
Was sehe ich?
Sie sehen eine sich stetig verdunkelnde, kreisrunde Fläche in Form einer Sonne, welche die typischen Farben eines Sonnenuntergangs durchläuft.
Warum sehe ich das?
In der Petrischale auf dem Tageslichtprojektor zersetzt sich Natriumthiosulfat durch die Einwirkung von Salzsäure langsam in gasförmiges Schwefeldioxid und kolloidalen Schwefel. Letzterer besitzt etwa die Größe der Wellenlänge es einfallenden Lichts (etwa \(400-800\,nm = 400-800\cdot10^{-9}\,m\)) und streut dieses deshalb. Dies bezeichnet man als Tyndall-Effekt. Kurzwelliges blaues Licht wird dabei stärker gestreut, als langwelliges rotes. Mit fortschreitender Reaktion entsteht mehr Schwefel, weshalb ein Farbwechsel von weiß über gelb nach tiefrot erfolgt, da letztendlich kaum blaues Licht die Lösung passieren kann.
\begin{align} Na_2S_2O_3 + 2 HCl &\rightarrow H_2S_2O_3 + 2 NaCl\\ H_2S_2O_3 &\rightarrow \frac{1}{8}S_8 + SO_2 + H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Ähnlich lässt sich der Sonnenuntergang in der Natur erklären, wobei hier die Weglänge des zurückgelegten Lichtes anstatt des Schwefels entscheidend ist.
Experiment 3: Teufelsträne
Was sehe ich?
Sie sehen einen extensiven Sprödbruch einer zerplatzenden Teufelsträne.
Warum sehe ich das?
Bei den sogenannten Teufelstränen (oder auch Bologneser Tränen) handelt es sich um Glastropfen in Tränenform. Diese werden hergestellt, in dem geschmolzenes Glas durch Eintropfen in Wasser schlagartig abgeschreckt wird, wodurch die gebildeten Tropfen unter Spannung stehen. Über eine kleine Wegänderung am langen ausgezogenen Ende der Träne wird eine überschallschnelle Ausbreitung der Bruchkante im gesamten Tropfen initiiert. Eine Verästelung der Bruchkante lässt die Träne explosionsartig in viele kleine Teile zerspringen.
Verweise auf Literatur bzw. Interessantes
Das dicke Ende der Träne ist so widerstandsfähig, dass er einen Hammerschlag ohne Weiteres aushält.
Neben den Bologneser Tränen gibt es auch Bologneser Flaschen (dicke, kugelförmige Flaschen), welche geeignet sind, einen Nagel in ein Brett zu schlagen. Lässt man jedoch den Nagel in die Flasche fallen, so zerspringt diese augenblicklich.
Experiment 4: PU-Schaum
Was sehe ich?
Es kann die Ausbildung eines voluminösen Schaumes aus Polyurethan beobachtet werden.
Warum sehe ich das?
Die Grundlage für die Bildung des Polyurethans bildet die Reaktion von Isocyanaten mit Alkoholen in Form einer Addition. Dabei wird die Ausbildung der sogenannten Urethangruppe beobachtet. Im Detail kommen organische Verbindungen mit jeweils zwei Isocyanat- bzw. Alkoholfunktionalitäten zum Einsatz. Daraus resultiert die Formulierung einer Polymerisation (Polyaddition) und die Darstellung des namensgebenden Polyurethans. Durch eine Nebenreaktion mit Luftfeuchtigkeit wird Kohlenstoffdioxid abgespalten, welches die Masse aufschäumt.
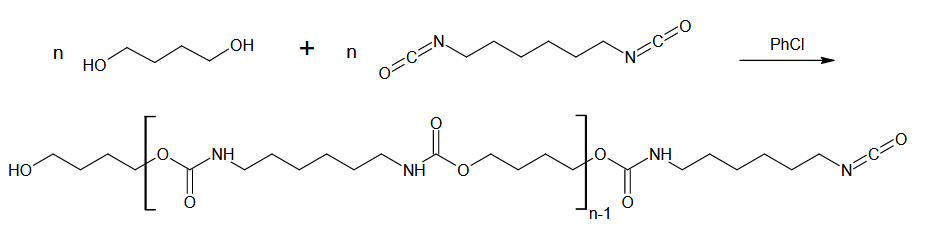
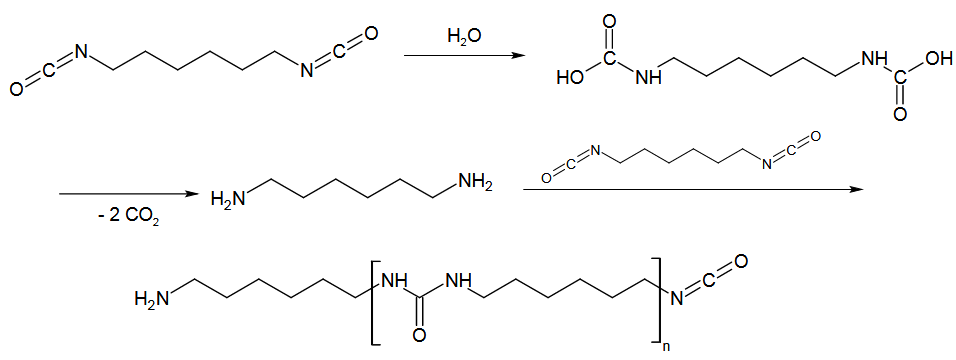
Verweise auf Literatur bzw. Interessantes
Der Einsatz von Polyurethan an sich aber auch als Schäume ist aus der modernen Gesellschaft gar nicht mehr wegzudenken. Es findet als Kunststoff vielfältige Anwendung z. B. in Form von Schaumstoffen im Textilbereich oder als Grundkomponente in Lacken.
Experiment 5: Springende Cola-Dose
Was sehe ich?
Sie sehen zuerst nur das Entzünden von Wasserstoff und hören nach kurzer Zeit einen lauten Knall.
Warum sehe ich das?
In der Dose befindet sich beim entzünden reiner Wasserstoff. Dieser tritt durch die obige Öffnung an der Dose aus und verbrennt mit farboser Flamme zu Wasser. Da die Dose unten eine Öffnung hat, strömt Luft (und damit Sauerstoff) von unten in die Dose nach. Somit bildet sich mit der Zeit Knallgas, eine explosionsfähige Mischung aus Sauerstoff und Wasserstoff. Dieser explodiert mit lautem Knall, wobei die sich ausdehnenden Reaktionsprodukte (Wasserdampf) die Dose in die Luft befördern.
\[ 2 H_2 + O_2 \rightarrow 2 H_2O \]Verweise auf Literatur bzw. Interessantes
Wasserstoff kann an der Luft ab etwa 4 vol-% verbrennen. Ab einer Volumenenkonzentration von 18 vol-% bis etwa 76 vol-% erfolgt die Reaktion explosionsartig.
Bei Fragen, Anmerkungen, Wünschen oder Hinweisen, kontaktieren Sie uns bitte unter folgender E-Mail-Adresse:
schauvorlesung@chemlist.tu-freiberg.de
Falls Sie uns unterstützen wollen oder Ihnen unsere Arbeit besonders gut gefallen hat, würden wir uns sehr über eine Spende freuen, mit der wir weitere Schauvorlesungen ermöglichen können.
Empfänger: Freunde und Förderer der TU Bergakademie Freiberg e. V.
IBAN: DE55 8705 2000 3115 0144 30 (BIC: WELADED1FGX)
Verwendungszweck: Onlineweihnachtsvorlesung der Fak. 2
Wir wünschen allen eine besinnliche Adventszeit!

