2. Akt
Nach dem großen Debakel macht sich der Alchemistenlehrling auf in die nahegelegene Stadt. Schafft er es rechtzeitig, die beschädigten Dinge vor dem Weihnachtsfest zu ersetzen? Mehr erfahrt ihr am 5. Dezember 2021, ab 12.00 Uhr.
Haben Sie folgende Anspielungen entdeckt?
Der 2. Akt unserer Weihnachtsvorlesung lehnt sich an die Ballade „Der Totentanz“ von J.W. von Goethe an. In der Ballade beobachtet ein Turmwächter, wie sich die Toten als Gerippe in der Nacht aus ihren Gräbern erheben und ihre Hemden ablegen, um tanzen zu können. Der Turmwächter stielt zum Spaß eines der Hemden. Als die Toten in ihre Gräber zurückkehren, bleibt einer zurück, da er sein Hemd nicht finden kann und beginnt, den Turm hinaufzuklettern, in welchem sich der Turmwächter versteckt. Als die Uhr jedoch eins schlägt, verliert das Gerippe seine Kraft und zerschellt am Boden.
Außerdem ist eine Anspielung auf die Ballade „Der Handschuh“ von F. Schiller enthalten. Im Original veranstaltet ein König einen Tierkampf mit einem Löwen, einem Tiger und zwei Leoparden. Mitten auf den Kampfplatz lässt eine Adlige ihren Handschuh fallen und beauftragt einen Ritter ihr zum Beweis seiner Liebe diesen zurückzuholen. Der Ritter betritt den Zwinger und schafft es, den Handschuh unversehrt zurückzubringen. Als er jedoch vor der Adligen steht, wirft er ihr den Handschuh ins Gesicht und lehnt ihre Dankbarkeit ab.
Experiment 1: Farbige Flammen
Was sehe ich?
Sie sehen Spiritusbrenner, deren Flammen farbig brennen.
Warum sehe ich das?
In den Spiritusbrennern befindet sich Methanol, in welchem Natriumchlorid (gelbe Flamme), Lithiumnitrat (rote Flamme), Borsäure (grüne Flamme) oder Indiumchlorid (indigoblaue Flamme) gelöst wurde. Durch die hohe Temperatur während der Reaktion des Methanols mit dem Sauerstoff der Luft (also der eigentlichen Verbrennung) werden die Außenelektronen der Metallkationen thermisch angeregt und geben beim Übergang in den Ausgangszustand die zuvor aufgenommene Energie in Form eines, für das jeweilige Element charakteristisch gefärbten, Lichts wieder ab. Die grüne Flamme des Borsäure-Methanol-Gemisches resultiert aus der Bildung des Borsäuretrimethylesters, welcher mit einer grünen Flamme verbrennt.
\begin{align} 2 CH_3OH + 3 O_2 &\rightarrow 2 CO_2 + 4 H_2O + \Delta T (mit~ \Delta T = Wärme)\\ NaCl + \Delta T &\rightarrow Na\cdot + Cl\cdot\\ InCl_3 + \Delta T &\rightarrow In\cdot + 3 Cl\cdot\\ 2 LiNO_3 + \Delta T &\rightarrow 2 Li\cdot + 2 NO_2 + O_2\\ M\cdot + \Delta T &\rightarrow M\cdot ^* \rightarrow M\cdot + h\cdot \nu \\ (mit~M = Metall, & ^* = angeregter~Zustand~und~h\cdot \nu = Licht)\\ B(OH)_3 + CH_3OH &\rightarrow B(OCH_3)_3 + 3 H_2O\\ 2 B(OCH_3)_3 + 9 O_2 &\rightarrow B_2O_3 + 6 CO_2 + 9 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Durch die photometrische Analyse des emittierten Lichts einer Sphalerit-Probe (Zinksulfid) aus dem Freiberger Revier konnten Ferdinand Reich und Hieronymus Theodor Richter 1863 an der Bergakademie Freiberg das Indium aufgrund seiner intensiven Indigoblauen Spektrallinie als neues Element identifizieren.
Die Reaktion von Borsäure mit Alkoholen wurde früher als Nachweis für Methanol genutzt, da der sich ergebende Borsäuretrimethylester eine komplett grüne Flamme bei der Verbrennung zeigt. Die Borsäureester von Alkoholen mit einem größeren Kohlenstoffanteil (zum Beispiel der Trinkalkohol Ethanol) zeigen bei der Verbrennung eine gelbliche Flamme mit grünem Saum, da der Kohlenstoff nicht vollständig zu Kohlenstoffdioxid oxidiert wird und die Rußpartikel in der Flamme gelb glühen. So kann Methanol in gepanschtem Trinkalkohol nachgewiesen werden.
Experiment 2: Verbrennen von rotem Phosphor
Was sehe ich?
Sie sehen eine helle gelbe Flamme in einem Kolben sowie das Entstehen eines weißen Nebels.
Warum sehe ich das?
Der Phosphor verbrennt in dem mit Sauerstoff gefüllten Kolben mit gelber Flamme unter Bildung von Phosphor(V)-oxid. Dies ist ein weißes Pulver, welches zunächst aufgrund der kleinen Partikel einen Nebel bildet und sich anschließend an den Gefäßwänden absetzt.
\[4 P + 5 O_2 \rightarrow P_4O_{10}\]Verweise auf Literatur bzw. Interessantes
Roter Phosphor wird beispielsweise auf den Reibflächen von Streichhölzern verwendet. Wird der Zündkopf des Streichholzes an der Reibfläche gerieben, wird in Spuren die sogenannte Armstrongsche Mischung (Mischung aus rotem Phosphor von der Reibfläche und Kaliumchlorat vom Zündkopf) gebildet. Diese ist hochexplosiv und kann so das Streichholz entzünden.
Experiment 3: Anzünden eines Nitrilhandschuhs mit rauchender Salpetersäure
Was sehe ich?
Nach Zugabe von wenigen Millilitern einer gelblichen Flüssigkeit auf einen Nitrilhandschuh fängt dieser lebhaft zu brennen an.
Warum sehe ich das?
Der Kunststoff des Handschuhs sieht in seiner Struktur wie folgt aus:
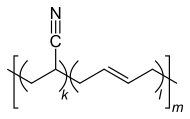
Ausgehend vom Acrylnitril-Butadien-Kautschuk sind freie Elektronenpaare am Nitrilstickstoff, durch radikalische Reaktion zugängliche C-H Gruppen, sowie elektrophile Doppelbindungen, vorhanden. Die zugesetzte Flüssigkeit ist 100 %-ige Salpetersäure (\(HNO_3\)). In den nachfolgenden Reaktionsgleichungen sind Reaktionen dieser mit der Nitrilfunktion (1), mit der Doppelbindung (2), mit tertiärem Kohlenstoff (3), und sekundärem Kohlenstoff (4) abgebildet.
\begin{align} 10 CN + 8 HNO_3 &\rightarrow 9 N_2 + 10 CO_2 + 4 H_2O & (1)\\ -HC=CH- + 2 HNO_3 &\rightarrow 2 CO_2 + 2 H_2O + N_2 & (2)\\ 2 ≡CH + 2 HNO_3 &\rightarrow 2 CO_2 + N_2 + 2 H_2O & (3)\\ 5 =CH_2 + 6 HNO_3 &\rightarrow 5 CO_2 + 3 N_2 + 8 H_2O & (4) \end{align}Die dargestellten Reaktionsgleichungen sind stark vereinfacht und idealisiert.
Konzentrierte 100 %-ige \(HNO_3\) kann durch Eigenprotolyse \(NO_2^+\)-Ionen bereitstellen. Diese können den Nitrilstickstoff und Doppelbindungen angreifen. Freie in Lösung befindliche Stickoxide können radikalisch mit den C-H-Gruppen reagieren. Generell ist die Oxidationskraft der 100 %-igen \(HNO_3\) sehr hoch. Somit werden organische Materialen zügig oxidiert. Nicht ideelle Verbrennung führt zu Stickoxiden und Ruß. Das vollständige Reaktionsnetzwerk ist sehr komplex.
Verweise auf Literatur bzw. Interessantes
Aus Sicherheitsgründen sollte zwingend darauf geachtet werden, keine Nitrilhandschuhe bei Arbeiten mit 100 %-iger \(HNO_3\) zu tragen! Bei Arbeiten mit diesen Säuren sind Säureschutzhandschuhe (Butylhandschuhe) zu verwenden.
Natronsalpeter (auch als Chilesalpeterbezeichnet, \(NaNO_3\)) war lange Zeit die Hauptquelle an Nitraten für die westliche Welt. Aufgrund der Wasserlöslichkeit der Nitrate ist u.a. Natronsalpeter nur in sehr trockenen Gebieten, wie Chile, zu finden. Der Salpeter musste per Schiff nach Europa im 19. Jahrhundert transportiert werden. Erst die Ammoniaksynthese (Haber-Bosch-Verfahren) Anfang des 20. Jahrhunderts und die Ammoniakverbrennung zu Stickoxiden (Ostwald-Verfahren) machte Europa unabhängig von Salpeterimporten aus Chile und sicherte die Nahrungsmittelversorgung Europas durch geeignete Düngung. Bedauerlicherweise wurde so auch die Herstellung von Sprengstoffen für die Weltkriege ermöglicht.
Experiment 4: Staubexplosion mit Lycopodium
Was sehe ich?
Sie sehen eine effektvolle Staubexplosion.
Warum sehe ich das?
Im Trichter befindet sich Lycopodium (auch bekannt als Bärlappsporen). Diese feinpulvrige Substanz besitzt bei feiner Verteilung eine sehr große Oberfläche und verbrennt deshalb explosionsartig mit dem Luftsauerstoff bei Wärmezufuhr.
Verweise auf Literatur bzw. Interessantes
In der Vergangenheit gab es hin und wieder Mehlstaubexplosionen in Mühlen, welche für viel Zerstörung gesorgt haben. Diese beruhten ebenfalls auf der feinen Verteilung des Mehls als Staub in der Luft und der damit einhergehenden großen reaktiven Oberfläche. Prinzipiell gilt: Je größer die Oberfläche zweier Reaktanden, desto schneller läuft eine Reaktion ab.
Experiment 5: Einfrieren und Zerschlagen von Pflanzen
Was sehe ich?
Sie sehen, wie eine Teil einer Zimmerpflanze in ein Dewar-Gefäß mit flüssigem Stickstoff getaucht wird. Nachdem der Zweig dann herausgenommen wird, ist er ganz spröde und lässt sich sehr einfach zerschlagen, wobei er in viele Einzelteile zerspringt.
Warum sehe ich das?
In dem Dewar-Gefäß befindet sich flüssiger Stickstoff. Dieser besitzt eine Temperatur von etwa −196 °C. Aufgrund dieser geringen Temperatur friert der Zweig innerhalb weniger Sekunden vollständig durch, d.h. das Wasser in den Zellen erstarrt komplett. Der Zweig verliert somit all seine Elastizität und wird spröde. Dadurch kann er sehr einfach zerschlagen werden.
Verweise auf Literatur bzw. Interessantes
Nicht nur wasserhaltige Gegenstände, wie Pflanzen oder menschliches Gewebe, kann bei extremer Kälte spröde werden. Gleiches gilt auch beispielsweise für Kunststoffe und Gummi. Sobald diese unter die sogenannte Glasübergangstemperatur abgekühlt werden, verlieren sie ihre elastischen Eigenschaften und können brechen. Diese Glasübergangstemperatur ist von der Struktur des Kunststoffes abhängig und kann auch genutzt werden, um diesen zu charakterisieren.S
Experiment 6: Iod-Vulkan
Was sehe ich?
Sie sehen ein Gemisch, welches bei der Hinzugabe von Wasser heftig mit diesem reagiert, wodurch intensiv violett gefärbter Rauch aufsteigt.
Warum sehe ich das?
Bei dem Gemisch handelt es sich um eine Mischung aus Aluminium- und Iodpulver. Bei Zugabe von Wasser reagieren diese stark exotherm miteinander unter Bildung von Aluminiumiodid. Das Wasser dient zur Herabsetzung der Aktivierungsenergie der Reaktion.
\[ 2 Al + 3 I_2 \rightarrow Al_2I_6 \]Durch die dabei freiwerdende Wärme heizt sich das Gemisch stark auf, was zum teilweisen verdampfen des Iods (welches nicht schmilzt, sondern sublimiert) führt. Das so gasförmig gewordene Iod sorgt für die violette Färbung des Rauches.
Verweise auf Literatur bzw. Interessantes
Wie in diesem Experiment zu sehen ist, handelt es sich bei Aluminium um ein unedles und damit sehr reaktives Metall. Dennoch begegnet uns Aluminium täglich in unserem Alltag (z. B. in Form von Dosen, Alufolie oder anderen leichten Metallbauteilen). Dies ist auch kein Problem, da das Aluminium mit dem Sauerstoff in der Luft reagiert und sich so mit einer dünnen, unreaktiven und ungiftigen Aluminiumoxidschicht überzieht. Diese schützt das restliche Aluminium vor Korrosion und wird auch als Veredelung (Eloxieren) genutzt.
Experiment 7: Zersetzung von Erdalkalisiliciden
Was sehe ich?
Sie sehen kleine Lichtblitze begleitet von einem Knisternden Geräusch.
Warum sehe ich das?
Bei dieser Reaktion handelt es sich um die Hydrolyse (Reaktion mit Wasser) von Dimagnesiumsilicid. Dabei entsteht Monosilan, welches mit dem Sauerstoff der Luft explosionsartig zu Siliciumdioxid (Sand) reagiert.
\begin{align} Mg_2Si + 4 HCl &\rightarrow 2 MgCl_2 + SiH_4 \\ SiH_4 + 2 O_2 &\rightarrow SiO_2 + 2 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Industriell werden Silane (Si-haltige organische Verbindungen) über das Müller-Rochow-Verfahren aus Silicium und Chlormethan hergestellt. Sie dienen als Ausgangsmaterial für Silikone, welche im Alltag breite Anwendung finden.
Bei Fragen, Anmerkungen, Wünschen oder Hinweisen, kontaktieren Sie uns bitte unter folgender E-Mail-Adresse:
schauvorlesung@chemlist.tu-freiberg.de
Falls Sie uns unterstützen wollen oder Ihnen unsere Arbeit besonders gut gefallen hat, würden wir uns sehr über eine Spende freuen, mit der wir weitere Schauvorlesungen ermöglichen können.
Empfänger: Freunde und Förderer der TU Bergakademie Freiberg e. V.
IBAN: DE55 8705 2000 3115 0144 30 (BIC: WELADED1FGX)
Verwendungszweck: Onlineweihnachtsvorlesung der Fak. 2
Wir wünschen allen eine besinnliche Adventszeit!

