3. Akt
Durch Glück im Unglück hat der Alchemistenlehrling den Baumschmuck in seinen Besitz gebracht. Doch ein abgebrannter Baum kann nicht geschmückt werden und deshalb muss jetzt ein neuer her...
Das und mehr seht ihr am 12. Dezember 2021, ab 12.00 Uhr.
Haben Sie folgende Anspielungen entdeckt?
Der 3. Akt unserer Weihnachtsvorlesung ist an die Ballade „Der Erlkönig“ von J. W. Goethe angelehnt. In der Originalballade reitet ein Vater mit seinem kranken Kind im Arm durch den Wald. Das Kind sieht und hört auf dem Weg durch den dunklen Wald in einem Fieberwahn den „Erlkönig“, der ihn mit verführerischen Worten in sein Reich locken will. Verängstigt erzählt das Kind seinem Vater davon, der verzweifelt versucht seinen Sohn zu beruhigen. Als sein Sohn immer panischer wird, reitet der Vater so schnell es geht nach Hause, doch als sie dort ankommen, ist das Kind in seinen Armen schon tot.
Daneben ist im Akt eine Anspielung auf den „Passierschein A38“ aus dem Zeichentrickfilm „Asterix erobert Rom“ von den Regisseuren Albert Uderzo, René Goscinny und Pierre Watrin. Im Film stellt Caesar Asterix und Obelix nach einer weiteren Niederlage zwölf Aufgaben, um zu überprüfen, ob es sich bei den Galliern um Götter handelt. In der achten Aufgabe sollen die beiden Gallier den „Passierschein A38“ aus dem „Haus, das Verrückte macht“ besorgen. Dabei werden sie kreuz und quer durch das Gebäude von einem Beamten zum nächsten geschickt, die sich alle als nicht zuständig ausgeben. Asterix erfindet schließlich den „Passierschein A39, wie er im neuen Rundschreiben B 65 festgelegt ist“. Daraufhin versucht ein Beamter nach dem anderen herauszufinden was es mit den unbekannten Papieren auf sich hat und es entsteht ein heilloses Durcheinander. Als der verzweifelte Präfekt dann von Asterix nach dem „Passierschein A38“ gefragt wird, zieht er ihn aus seiner Tasche und übergibt ihn Asterix, wodurch diese Aufgabe gelöst ist.
Experiment 1: Farbige Flammen
Was sehe ich?
Sie sehen Spiritusbrenner, deren Flammen farbig brennen.
Warum sehe ich das?
In den Spiritusbrennern befindet sich Methanol, in welchem Natriumchlorid (gelbe Flamme), Lithiumnitrat (rote Flamme), Borsäure (grüne Flamme) oder Indiumchlorid (indigoblaue Flamme) gelöst wurde. Durch die hohe Temperatur während der Reaktion des Methanols mit dem Sauerstoff der Luft (also der eigentlichen Verbrennung) werden die Außenelektronen der Metallkationen thermisch angeregt und geben beim Übergang in den Ausgangszustand die zuvor aufgenommene Energie in Form eines, für das jeweilige Element charakteristisch gefärbten, Lichts wieder ab. Die grüne Flamme des Borsäure-Methanol-Gemisches resultiert aus der Bildung des Borsäuretrimethylesters, welcher mit einer grünen Flamme verbrennt.
\begin{align} 2 CH_3OH + 3 O_2 &\rightarrow 2 CO_2 + 4 H_2O + \Delta T (mit~ \Delta T = Wärme)\\ NaCl + \Delta T &\rightarrow Na\cdot + Cl\cdot\\ InCl_3 + \Delta T &\rightarrow In\cdot + 3 Cl\cdot\\ 2 LiNO_3 + \Delta T &\rightarrow 2 Li\cdot + 2 NO_2 + O_2\\ M\cdot + \Delta T &\rightarrow M\cdot ^* \rightarrow M\cdot + h\cdot \nu \\ (mit~M = Metall, & ^* = angeregter~Zustand~und~h\cdot \nu = Licht)\\ B(OH)_3 + CH_3OH &\rightarrow B(OCH_3)_3 + 3 H_2O\\ 2 B(OCH_3)_3 + 9 O_2 &\rightarrow B_2O_3 + 6 CO_2 + 9 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Durch die photometrische Analyse des emittierten Lichts einer Sphalerit-Probe (Zinksulfid) aus dem Freiberger Revier konnten Ferdinand Reich und Hieronymus Theodor Richter 1863 an der Bergakademie Freiberg das Indium aufgrund seiner intensiven Indigoblauen Spektrallinie als neues Element identifizieren.
Die Reaktion von Borsäure mit Alkoholen wurde früher als Nachweis für Methanol genutzt, da der sich ergebende Borsäuretrimethylester eine komplett grüne Flamme bei der Verbrennung zeigt. Die Borsäureester von Alkoholen mit einem größeren Kohlenstoffanteil (zum Beispiel der Trinkalkohol Ethanol) zeigen bei der Verbrennung eine gelbliche Flamme mit grünem Saum, da der Kohlenstoff nicht vollständig zu Kohlenstoffdioxid oxidiert wird und die Rußpartikel in der Flamme gelb glühen. So kann Methanol in gepanschtem Trinkalkohol nachgewiesen werden.
Experiment 2: Chemischer Garten
Was sehe ich?
Sie sehen verschiedene farbige pflanzenartige Gebilde, welche vom Boden des Glases nach oben wachsen.
Warum sehe ich das?
In dem Glas befindet sich eine Natriummetasilikatlösung, auch bekannt als Natronwasserglas. In diese wurden Kristalle unterschiedlicher Metallsalze (\(M^{x+}\)) gegeben. \[ M^{x+} + SiO_3^{2-} \rightarrow M_{\frac{2}{x}}SiO_3 \]
Die Metallsalze lösen sich in der wässrigen Lösung auf, werden jedoch sofort wieder durch die vorhandenen Silikationen als farbige Metallsilikate ausgefällt, welche eine semipermeable Membran formen. Durch diese kann nun Wasser aus der Silikatlösung in den Zwischenraum zwischen noch nicht gelöstem Kristall und Membran strömen, da in diesem die Salzkonzentration deutlich höher ist, als außerhalb der Membran (Osmose). Das Einströmen des Wasser bewirkt nun ein Ausdehnen der Membran, bis diese an der schwächsten Stellte platzt. An dieser Stelle kommt nun wieder die Metallsalzlösung mit der Silikatlösung in Kontakt und formt eine neue Membran. Es kommt zum Wachsen des Gebildes. Am höchsten Punkt der Membran ist die Salzkonzentraion am geringsten und somit auch die Membran am dünnsten. Somit platzt die Membran hier bevorzugt auf und die Gebilde wachsen wie Pflanzen nach oben.
Verweise auf Literatur bzw. Interessantes
Da das Wachsen der Gebilde nach oben auf die Schwerkraft zurückzuführen ist, sieht ein chemischer Garten, welcher in der Schwerelosigkeit gezüchtet wurde, vermutlich deutlich anders aus. Dies wird zum Beispiel von der NASA untersucht, indem auf der ISS chemische Gärten „angelegt“ werden.
Link zur NASA-Seite
Experiment 3: Nebel mit flüssigem Stickstoff
Was sehe ich?
Sie sehen, wie weißer Nebel aus einer Metallschüssel entweicht, nachdem warmes Wasser hineingegossen wurde.
Warum sehe ich das?
In der Metallschüssel befindet sich flüssiger Stickstoff. Dieser besitzt eine Temperatur von weniger als −196 °C. Sobald dieser mit dem Wasser, welches Raumtemperatur besitzt, in Kontakt kommt, verdampft der Stickstoffes, welcher dann aus dem Becherglas entweicht. Das entweichende Gas ist noch sehr kalt, sodass die Luftfeuchtigkeit aus der Umgebungsluft kondensiert und so als weißer Nebel sichtbar wird.
Das entweichende Gas ist noch sehr kalt, sodass die Luftfeuchtigkeit aus der Umgebungsluft kondensiert und so als weißer Nebel sichtbar wird.
Verweise auf Literatur bzw. Interessantes
Gewöhnlichen Nebel, welchen wir in der Natur beobachten können, kann in ähnlicher Weise, wie in diesem Experiment, entstehen. Dabei kommt es meist aufgrund der Abkühlung der Luft zur Übersättigung dieser mit Wasser, welches dann kondensiert und als feinverteilte Tröpfchen in der Luft vorliegt.
Experiment 4: Supraleiter
Was sehe ich?
Sie sehen einen Supraleiter über einer Magnetbahn schweben.
Warum sehe ich das?
Supraleiter stellen unterhalb einer bestimmten Temperatur (Tkrit), Magnetfeldstärke (Hkrit) und Stromstärke (Ikrit) einen perfekten Diamagneten dar. Das heißt, dass ein äußeres Magnetfeld das Material aufgrund von an der Oberfläche induzierten Strömen nicht mehr durchdringen kann. Dieser Zustand wird als Meißner-Phase bezeichnet. Die auf der Oberfläche des Supraleiters induzierten Ströme induzieren wiederum ein Magnetfeld, welches dem Magnetfeld des Magneten entgegen gerichtet ist, wodurch dieser schwebt. Dieser Effekt wird als Meißner-Ochsenfeld-Effekt bezeichnet.
Verweise auf Literatur bzw. Interessantes
Dieser Effekt wird beispielsweise in Magnetschwebebahnen eingesetzt, wobei die Gleise aus vielen Permanent- oder Elektromagneten bestehen und sich das supraleitende Material, welches mit flüssigem Stickstoff gekühlt wird, im Zug befindet.
Experiment 5: Bellender Hund
Was sehe ich?
Sie sehen, wie sich eine blaue Flamme durch einen Messzylinder bewegt. Dabei ist ein Geräusch zu hören, welches dem Bellen eines Hundes ähnelt.
Warum sehe ich das?
In dem Messzylinder befindet sich ein Gemisch aus gasförmigen Distickstoffmonoxid und flüssigem Kohlenstoffdisulfid. Durch Entzünden des Gemisches mit der Brennerflamme findet folgende Reaktion statt:
\[3 N_2O + CS_2 \rightarrow CO + 3 N_2 + SO_2 + \frac{1}{8} S_8 \]Abgesehen vom Schwefel, entstehen bei dieser Reaktion nur gasförmige Stoffe, was zur raschen Ausdehnung des Volumens führt. Diese Ausdehnung ist in Form eines Geräusches zu hören, welches Ähnlichkeiten zu dem Bellen eines Hundes aufweist.
Verweise auf Literatur bzw. Interessantes
Distickstoffmonoxid ist besser unter dem Namen Lachgas bekannt. So wird es aufgrund seiner schmerzunterdrückenden Wirkung häufig als relativ nebenwirkungsarmes Narkosemittel eingesetzt. Weiterhin wird es beim Leistungstuning von Verbrennungsmotoren genutzt.
Experiment 6: Schnee aus Metaldehyd
Was sehe ich?
Sie sehen die Bildung von großen voluminösen weißen Flocken aus einer festen Substanz, die auf einer Heizplatte liegt.
Warum sehe ich das?
Bei dem verwendeten Stoff handelt es sich um Metaldehyd, welches durch die Erwärmung sublimiert, also seinen Aggregatzustand direkt von fest nach gasförmig ändert, ohne flüssig zu werden. Sobald das gasförmige Metaldehyd oberhalb der Heizplatte etwas abgekühlt ist, resublimiert es als voluminöses Material, was in seiner Erscheinungsform Schneeflocken ähnelt.
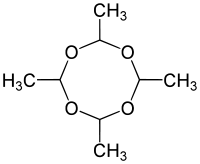
Verweise auf Literatur bzw. Interessantes
Die Verbindung entsteht durch Kondensation von vier Molekülen Acetaldehyd, welches das Abbauprodukt von Trinkalkohol (Ethanol) im menschlichen Körper darstellt. Die Kondensationsreaktion tritt dort jedoch nicht auf, da das Acetaldehyd in Essigsäure umgewandelt wird.
Experiment 7: Tee des Teufels
Was sehe ich?
Bei der Zugabe des Pfefferminzteebeutels kann beobachtet werden, wie sich langsam eine rote Lumineszenz in der Tasse ausbreitet.
Warum sehe ich das?
Der Tee des Teufels setzt sich aus Wasserstoffperoxid und Oxalsäureestern von Phenolen mit elektronenziehenden Substituenten (wie Nitro- oder Chlorgruppen) zusammen. Die elektronenarmen Phenole sind gute Abgangsgruppen, wodurch es möglich ist, mithilfe ihrer Oxalsäureester Wasserstoffperoxid zu acylieren. Dabei entsteht wahrscheinlich das 1,2-Dioxetandion, welches mit fluoreszenzfähigen Verbindungen reagieren kann. Es wird eine chemisch initiierte Elektronen-Austausch-Lumineszenz beobachtet, bei der das 1,2-Dioxetandion nach Energieübertragung auf eine fluoreszenzfähige Verbindung letztlich zu Kohlenstoffdioxid zerfällt und die fluoreszenzfähige Verbindung in einem angeregten Zustand hinterlässt. Beim Teufelstee handelt es sich bei der fluoreszenzfähigen Verbindung um Chlorophyll, welches aus den Pfefferminzblättern des Teebeutels stammt. Das angeregte Chlorophyll relaxiert aus dem angeregten Zustand in den Grundzustand und sendet dabei ein wunderschönes rotes Licht aus.
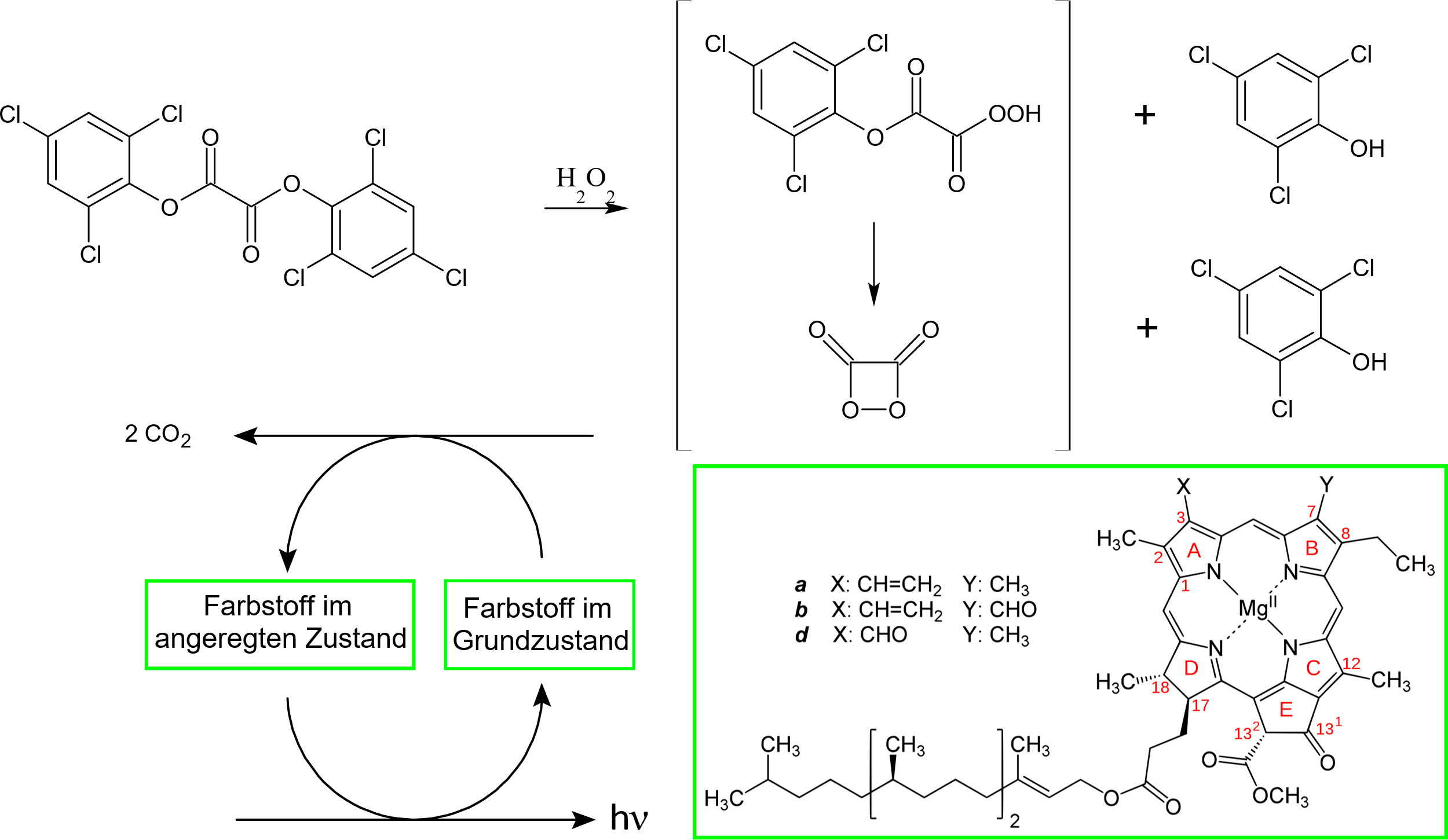
Verweise auf Literatur bzw. Interessantes
Theoretisch funktioniert der Versuch mit sehr vielen Teesorten. Entscheidend ist der Chlorophyllgehalt des Tees, wobei dieser im Pfefferminztee besonders hoch ist. Das hier angewandte Wasserstoffperoxid-Oxalsäureester-Chemilumineszenzsystem wird unter anderem in Knicklichtern angewandt. Dabei werden als fluoreszenzfähige Verbindung statt Chlorophyll andere Fluoreszenzfarbstoffe verwendet. Als Oxalsäureester wird vor allem auf das Bis(2,4,6-trichlorphenyl)-oxalat zurückgegriffen. Aus diesem entsteht bei der Reaktion 2,4,6-Trichlorphenol.
Bei Fragen, Anmerkungen, Wünschen oder Hinweisen, kontaktieren Sie uns bitte unter folgender E-Mail-Adresse:
schauvorlesung@chemlist.tu-freiberg.de
Falls Sie uns unterstützen wollen oder Ihnen unsere Arbeit besonders gut gefallen hat, würden wir uns sehr über eine Spende freuen, mit der wir weitere Schauvorlesungen ermöglichen können.
Empfänger: Freunde und Förderer der TU Bergakademie Freiberg e. V.
IBAN: DE55 8705 2000 3115 0144 30 (BIC: WELADED1FGX)
Verwendungszweck: Onlineweihnachtsvorlesung der Fak. 2
Wir wünschen allen eine besinnliche Adventszeit!

