3. Strophe
Wie geht es weiter, nachdem Dr. Grantler vom Geist der vergangenen Weihnacht besucht wurde? War es doch nur ein Traum? Ab dem 3. Advent, dem 13. Dezember 2020, 12.00 Uhr könnt ihr mehr erfahren!
Was sehe ich?
Sie sehen Spiritusbrenner, deren Flamme farbig brennt.
Warum sehe ich das?
In den Spiritusbrennern befindet sich Methanol, in welchem Natriumchlorid (gelbe Flamme), Lithiumnitrat (rote Flamme), Borsäure (grüne Flamme) oder Indiumchlorid (indigoblaue Flamme) gelöst würde. Durch die hohe Temperatur während der Reaktion des Methanols mit dem Sauerstoff der Luft (also der eigentlichen Verbrennung) werden die Außenelektronen der Metallkationen thermisch angeregt und geben beim Übergang in den Ausgangszustand die zuvor aufgenommene Energie in Form eines für das jeweilige Element charakteristisch gefärbten Lichts wieder ab. Borsäuretrimethylester bildet sich aus der Borsäure und dem Methanol verbrennt mit grüner Flamme.
\begin{align} 2 CH_3OH + 3 O_2 &\rightarrow 2 CO_2 + 4 H_2O + \Delta T (mit~ \Delta T = Wärme)\\ NaCl + \Delta T &\rightarrow Na\cdot + Cl\cdot\\ InCl_3 + \Delta T &\rightarrow In\cdot + 3 Cl\cdot\\ 2 LiNO_3 + \Delta T &\rightarrow 2 Li\cdot + 2 NO_2 + O_2\\ M\cdot + \Delta T &\rightarrow M\cdot ^* \rightarrow M\cdot + h\cdot \nu \\ (mit~M = Metall, & ^* = angeregter~Zustand~und~h\cdot \nu = Licht)\\ B(OH)_3 + CH_3OH &\rightarrow B(OCH_3)_3 + 3 H_2O\\ 2 B(OCH_3)_3 + 9 O_2 &\rightarrow B_2O_3 + 6 CO_2 + 9 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Durch die photometrische Analyse des emittierten Lichts einer Sphalerit-Probe (Zinksulfid) aus dem Freiberger Revier konnten Ferdinand Reich und Hieronymus Theodor Richter 1863 an Bergakademie Freiberg das Indium aufgrund seiner intensiven Indigoblauen Spektrallinie als neues Element identifizieren.
Die Reaktion von Borsäure mit Alkoholen wurde früher als Nachweis für Methanol genutzt, da der sich ergebende Borsäuretrimethylester eine komplett grüne Flamme bei der Verbrennung zeigt. Die Borsäureester von Alkoholen mit einem größeren Kohlenstoffanteil (zum Beispiel der Trinkalkohol Ethanol) zeigen bei der Verbrennung eine gelbliche Flamme mit grünem Saum, da der Kohlenstoff nicht vollständig zu Kohlenstoffdioxid oxidiert wird und die Rußpartikel in der Flamme gelb glühen. So kann Methanol in gepanschtem Trinkalkohol nachgewiesen werden.
Was sehe ich?
Sie sehen den explosionsartigen Zerfall von Iodstickstoff, nachdem dieser mit einem Metallstab berührt wurde. Dabei treten violette Dämpfe auf.
Warum sehe ich das?
Iodstickstoff ist eine äußerst stoß-, reib-, schlag- und temperaturempfindliche Verbindung. Sie zerfällt bei Einwirkungen eines äußeren Reizes in die Elemente. Die violetten Dämpfe zeigen sich verflüchtigendes Iod an. \[ 2 NI_3 \rightarrow N_2 + 3 I_2 \]
Verweise auf Literatur bzw. Interessantes
Die Verbindung ist zu instabil, um eine praktische Verwendung als Sprengstoff zu besitzen. Sie eignet sich aber hervorragend, um die Stabilität von molekularem Stickstoff im Gegensatz zu einigen Stickstoffverbindungen aufzuzeigen.
Was sehe ich?
Sie sehen die Bildung von großen voluminösen weißen Flocken aus einer festen Substanz, die auf einer Heizplatte liegt.
Warum sehe ich das?
Bei dem verwendeten Stoff handelt es sich um Metaldehyd, welches durch die Erwärmung sublimiert, also seinen Aggregatzustand direkt von fest nach gasförmig ändert, ohne flüssig zu werden. Sobald das gasförmige Metaldehyd oberhalb der Heizplatte etwas abgekühlt ist, resublimiert es als voluminöses Material, was in seiner Erscheinungsform Schneeflocken ähnelt.
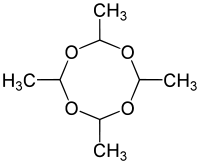
Verweise auf Literatur bzw. Interessantes
Die Verbindung entsteht durch Kondensation von vier Molekülen Acetaldehyd, welches das Abbauprodukt von Trinkalkohol (Ethanol) im menschlichen Körper darstellt. Die Kondensationsreaktion tritt dort jedoch nicht auf, da das Acetaldehyd in Essigsäure umgewandelt wird.
Was sehe ich?
Bei Zugabe der Reagenzien in den Standzylinder entsteht schlagartig ein großer gelber Schaum, welcher aus dem Zylinder entweicht.
Warum sehe ich das?
Das Wesen dieser Reaktion liegt im Zerfall des Wasserstoffperoxids in Sauerstoff und Wasser. Durch den Einsatz des Iodids wird diese exotherme Reaktion katalysiert, was zur Folge hat, dass das gebildete Wasser als Gas entweicht. Die Produkte bringen daraufhin die Seifenlösung stark zum schäumen, wodurch diese aus dem Zylinder treten. \begin{align} I^- + H_2O_2 &\rightarrow IO^- + H_2O\\ OI^- + H_2O_2 &\rightarrow I^- + H_2O + O_2 \end{align} Die Gelbfärbung entsteht durch eine Nebenreaktion, bei der das Iodid zu Iod oxidiert wird. \[ 2 I^- + H_2O_2 + 2 H_3O^+ \rightarrow 4 H_2O + I_2 \]
Verweise auf Literatur bzw. Interessantes
Die Elefantenzahnpasta ist eines der bekanntesten und meist gesehenen Experimenten. Da der Versuch ein niedriges Gefahrenrisiko besitzt und zudem optisch sehr eindrucksvoll kann es hervorragend für den Schulunterricht genutzt werden.
Der Reaktion kann zudem ein Farbstoff (z.B. in Form von Lebensmittelfarben) zugesetzt werden, um die verschiedensten Schäume zu erzeugen.
Was sehe ich?
Glühende Flocken schwirren wie Glühwürmchen wild umher.
Warum sehe ich das?
Der Kolben ist mit Luft und Ammoniak gefüllt. Durch die Zugabe von heißen Chrom(III)-oxid-Pulver wird die Reaktion von Ammoniak mit dem Sauerstoff aus der Luft (Verbrennung) katalysiert. Dabei wird so viel Energie frei, dass das Chrom(III)-oxid beginnt zu glühen. Im Versuch wurde besonders feines Chrom(III)-oxid-Pulver verwendet, sodass die glühenden Flocken durch Konvektion im Kolben herumschwirren und es wie Glühwürmchen aussieht. \[ 4\; NH_3 + 3\; O_2 \xrightarrow{Cr_2O_3} 2\; N_2 + 6\; H_2O \]
Verweise auf Literatur bzw. Interessantes
Die Oxidation von Ammoniak kann auch andere Produkte, wie Stickstoffmonoxid oder Lachgas liefern. Stickstoffmonoxid ist im Ostwald-Verfahren zur Salpetersäuregewinnung das Zielprodukt. Auch hier wird Ammoniak mit Sauerstofff oxidiert. Durch den gezielten Einsatz von Katalysatoren (beim Ostwald-Verfahren ein Platin-Rhodium-Katalysator) und die gezielte Wahl der Reaktionsparameter Druck und Temperatur kann beeinflusst werden, welches Hauptprodukt entsteht.
Bei Fragen, Anmerkungen, Wünschen oder Hinweisen, kontaktieren Sie uns bitte unter folgender E-Mail-Adresse:
schauvorlesung@chemlist.tu-freiberg.de
oder nutzen Sie unser Kontaktformular

