1. Strophe
Ein einsames erleuchtetes Fenster am Vorabend zum Heiligabend im Clemens-Winkler-Bau, dem Chemiegebäude der TU Bergakademie Freiberg. Was hat es damit nur auf sich? Wer arbeitet so kurz vor Weihnachten noch? Das erfahrt ihr am 1. Advent, am 29. November 2020 ab 12.00 Uhr hier auf der Webseite.
Was sehe ich?
Sie sehen Spiritusbrenner, deren Flamme farbig brennt.
Warum sehe ich das?
In den Spiritusbrennern befindet sich Methanol, in welchem Natriumchlorid (gelbe Flamme), Lithiumnitrat (rote Flamme), Borsäure (grüne Flamme) oder Indiumchlorid (indigoblaue Flamme) gelöst würde. Durch die hohe Temperatur während der Reaktion des Methanols mit dem Sauerstoff der Luft (also der eigentlichen Verbrennung) werden die Außenelektronen der Metallkationen thermisch angeregt und geben beim Übergang in den Ausgangszustand die zuvor aufgenommene Energie in Form eines für das jeweilige Element charakteristisch gefärbten Lichts wieder ab. Borsäuretrimethylester bildet sich aus der Borsäure und dem Methanol verbrennt mit grüner Flamme.
\begin{align} 2 CH_3OH + 3 O_2 &\rightarrow 2 CO_2 + 4 H_2O + \Delta T (mit~ \Delta T = Wärme)\\ NaCl + \Delta T &\rightarrow Na\cdot + Cl\cdot\\ InCl_3 + \Delta T &\rightarrow In\cdot + 3 Cl\cdot\\ 2 LiNO_3 + \Delta T &\rightarrow 2 Li\cdot + 2 NO_2 + O_2\\ M\cdot + \Delta T &\rightarrow M\cdot ^* \rightarrow M\cdot + h\cdot \nu \\ (mit~M = Metall, & ^* = angeregter~Zustand~und~h\cdot \nu = Licht)\\ B(OH)_3 + CH_3OH &\rightarrow B(OCH_3)_3 + 3 H_2O\\ 2 B(OCH_3)_3 + 9 O_2 &\rightarrow B_2O_3 + 6 CO_2 + 9 H_2O \end{align}Verweise auf Literatur bzw. Interessantes
Durch die photometrische Analyse des emittierten Lichts einer Sphalerit-Probe (Zinksulfid) aus dem Freiberger Revier konnten Ferdinand Reich und Hieronymus Theodor Richter 1863 an Bergakademie Freiberg das Indium aufgrund seiner intensiven Indigoblauen Spektrallinie als neues Element identifizieren.
Die Reaktion von Borsäure mit Alkoholen wurde früher als Nachweis für Methanol genutzt, da der sich ergebende Borsäuretrimethylester eine komplett grüne Flamme bei der Verbrennung zeigt. Die Borsäureester von Alkoholen mit einem größeren Kohlenstoffanteil (zum Beispiel der Trinkalkohol Ethanol) zeigen bei der Verbrennung eine gelbliche Flamme mit grünem Saum, da der Kohlenstoff nicht vollständig zu Kohlenstoffdioxid oxidiert wird und die Rußpartikel in der Flamme gelb glühen. So kann Methanol in gepanschtem Trinkalkohol nachgewiesen werden.
Was sehe ich?
Sie sehen eine Farbumschlag von farblos nach rosa.
Warum sehe ich das?
Es handelt sich um eine klassische Säure-Base-Reaktion. Durch die Änderung des pH-Wertes ändert sich die chemische Struktur eines so genannten Indikators (hier: Phenolphthalein), wodurch sich die Absorptionsbanden in Bezug auf das sichtbare Licht verschieben, was wir in Form der Komplementärfarbe wahrnehmen.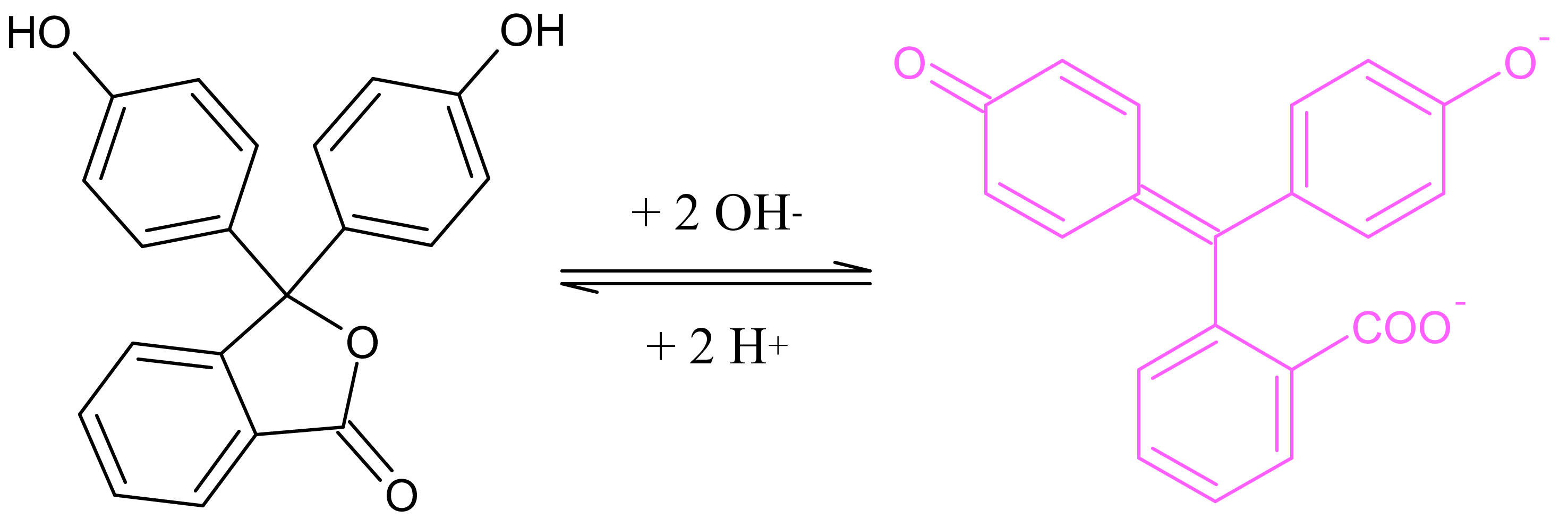
Verweise auf Literatur bzw. Interessantes
In Naturwissenschaft und Technik werden Indikatoren zur Bestimmung von Konzentrationen genutzt. Zum Beispiel kann so in einem Klärwerk die Reinheit von aufbereitetem Wasser bestimmt werden. Auch für die Züchtung von Fisch ist eine genaue Überwachung des pH-Wertes wichtig.
Was sehe ich?
Sie sehen das Verrosten von Stahl auf effektvolle Art und Weise.
Warum sehe ich das?
Die Stahlwolle besteht hauptsächlich aus Eisen. Dieses ist in der Lage, mit dem Sauerstoff der Luft zu reagieren, wobei sich Eisenoxid bildet, welches einer der Bestandteile von Rost ist. Dieser Vorgang vollzieht sich normalerweise auf einer sehr langsamen Zeitskala von Minuten bis Jahren. Da das Eisen hier aber eine große Oberfläche besitzt und durch das Entzünden mit einem Gasbrenner Aktivierungsenergie zugeführt wird, läuft die Reaktion deutlich schneller ab, als beim gewöhnlichen Rostvorgang. \[ 4 Fe + 3 O_2 \rightarrow 2 Fe_2O_3 \]
Verweise auf Literatur bzw. Interessantes
Um ein in der Anwendung ungewolltes Verrosten zu verhindern, werden Rostschutzbeschichtungen aufgebracht. Diese können aus Polymeren (Rostschutzlegierungen) oder anderen Metallen bestehen (Zink bei Gärtenzäunen oder Zinn bei Konservendosen).
Was sehe ich?
Sie sehen ein intensives rotes Leuchten in der Teetasse nach der Zugabe von zwei Flüssigkeiten in diese. Beim genauen Hinsehen fällt weiterhin auf, dass zuerst eine bläuliche Lichterscheinung wahrnehmbar ist.
Warum sehe ich das?
Bei dieser Reaktion reagiert ein Stoff namens Luminol mit Wasserstoffperoxid in einer so genannten Chemolumineszenzreaktion unter Aussendung blauen Lichts. Im Teebeutel befindet sich der Fluoreszenzfarbstoff Rhodamin B, welcher durch das Licht selbst angeregt wird und dann rotes Licht ausstrahlt. 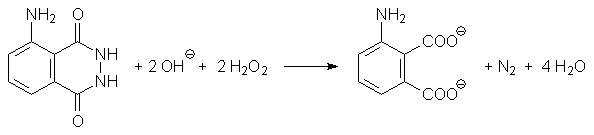
Verweise auf Literatur bzw. Interessantes
Als Katalysator für diese Reaktion werden zum Beispiel Eisen-Ionen benötigt, welche hier als rotes Blutlaugensalz zugesetzt wurden, aber auch im Blut vorhanden sind. Deshalb dient die Reaktion auch zur Identifizierung von Blutspuren in der Kriminaltechnik.
Was sehe ich?
Sie sehen ein anfangs blaues, später gelbliches, sich bewegendes Plasma in einem in der Mikrowelle stehenden Becherglas.
Warum sehe ich das?
Auf dem Drehteller der Mikrowelle befinden sich kleine Teile von Aluminiumfolie. Beim Einschalten der Mikrowelle werden die elektrisch leitfähigen Aluminiumstücke im elektromagnetischen Feld der Mikrowelle polarisiert. Durch die Drehbewegung des Tellers ändert sich diese Polarisierung ständig. Dadurch kommt es zu sehr starken Glimmentladungen, welche im Becherglas durch das elektromagnetische Feld als Plasma stabilisiert werden können. Dieses emittiert blaues Licht, welches aber durch die hohe Temperatur zur Anregung von Natrium-Atomen im Borosilikatglas des Becherglases führt und somit mit fortschreitender Versuchsdauer gelb wird.
Verweise auf Literatur bzw. Interessantes
Prinzipiell eignen sich für diesen Versuch auch andere elektrisch leitfähige Materialien wie eine fast vollständig halbierte Weintraube oder eine herkömmliche CD bzw. Ionenquellen wie ein Teelicht oder ein Streichholz.
Bei Fragen, Anmerkungen, Wünschen oder Hinweisen, kontaktieren Sie uns bitte unter folgender E-Mail-Adresse:
schauvorlesung@chemlist.tu-freiberg.de
oder nutzen Sie unser Kontaktformular

